上海臻诺生物科技有限公司代理商
9 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
推荐产品
公司新闻/正文
蛋白电泳常见问题及解决方法
309 人阅读发布时间:2025-06-10 10:58


● 电场强度——电场强度越大,蛋白质在凝胶中的迁移速度越快。这是因为在高强度的电场中,蛋白质移动速度会增加。
● 蛋白质性质——包括蛋白质的电荷数量、大小和形状。带电荷量越多的蛋白质在电场中的迁移速度越快。蛋白质的大小和形状也会影响迁移率,较小的蛋白质通常迁移得更快。
● 凝胶介质——凝胶的孔径大小和凝胶的离子浓度会影响蛋白质的迁移率。蛋白质在凝胶中的迁移过程中,会通过凝胶的孔径,而孔径的大小会限制蛋白质的迁移路径,从而影响迁移率。
● 缓冲液成分——电泳缓冲液的pH值和离子强度可以影响蛋白质的电荷状态,从而影响其迁移率。此外,缓冲液中的添加剂如SDS(十二烷基硫酸钠)可以影响蛋白质的结构,使其在凝胶中均匀带电,从而影响迁移率。

根据样本类型、分离类型和分子量查找符合您研究需求的预制胶。
● 根据蛋白分子量选择预制胶浓度
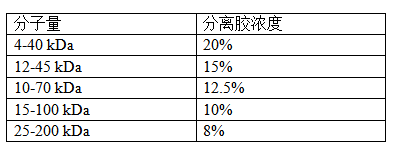
对于分子量较小的靶标蛋白(如分子量<25kDa,请使用较高浓度的分离胶进行电泳)。
对于分子量较大的靶标蛋白(如分子量>100kDa,请使用较低浓度的分离胶进行电泳)。
● 选择合适的凝胶体系
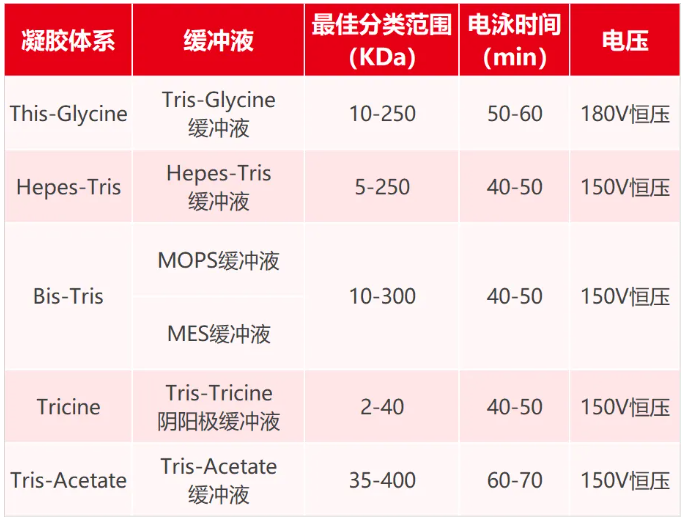
● 选择凝胶尺寸和孔数
根据实验需求选择合适的尺寸(0.75mm、1.0mm、1.5mm)孔数(如10孔、15孔),以优化上样效率和实验通量。

1. 关于凝胶的一些问题
1. 胶的凝结不好,凝胶不均匀。
解决方法:加大TEMED和过硫酸胺的量,使其凝结速度加快。同时洗干净玻璃板,防止有残留的胶干结在玻璃板上。过硫酸胺必须新鲜配制。如若还是不行重新配制一下缓冲溶液。建议电泳缓冲液不要回收利用。配制胶的溶液一定要纯。
2. 凝胶时间不对
通常胶在30分钟到1小时内凝。如果凝的太慢,可能是TEMED,AP剂量不够。如果凝的太快,可能是AP和TEMED用量过多,此时胶太硬易裂,电泳时易烧胶。
3. 浓缩胶与分离胶断裂、板间有气泡对电泳的影响
前者主要原因是拔梳子用力不均匀或过猛所致;后者是由于在解除制胶的夹子后,板未压紧而致空气进入引起的,一般对电泳结果不会有太大的影响。
4. 样品的处理
根据样品分离目的不同,主要有三种处理方法:还原SDS处理、非还原SDS处理、带有烷基化作用的还原SDS处理。
1.还原SDS处理:在上样buffer中加入SDS和DTT(或Beta巯基乙醇)后,形成SDS与蛋白相结合的分子。
2.带有烷基化作用的还原SDS处理:碘乙-酸胺的烷基化作用可以很好的保护SH基团,得到较窄的谱带;另碘乙-酸胺可捕集过量的DT,而防止纹理现象的产生。100uL样品缓冲液中加入10uL20%的碘乙-酸胺,并在25℃下保藏30min。
3.非还原SDS处理:生理体液、血清、尿素等样品,一般只用1%SDS沸水中煮3min,未加还原剂,因而蛋白折叠未被破坏,不可作为测定分子量来使用。
5. 条带两边翘起中间凹下的原因(︶)
在较厚的凝胶中,由于凝胶不均匀冷却,中间部分凝同不好。电泳系统温度偏高。
处理办法:待其充分凝固再作后续实验。
6.条带两边向下中间鼓起的原因(⌒)
一般原因是两板之间的底部间隙气泡未排除干净,或聚合不完全。
处理办法:可在两板间加入适量缓冲液,以排除气泡。
7.电泳的条带过粗
电泳中条带很粗主要是浓缩胶的原因。
处理办法:适当增加浓缩胶的长度,保证浓缩胶的PH正确,适当降低电压。
8.拖尾现象
主要是样品溶解效果不佳或分离胶浓度过大引起的。
处理方法:加样前离心,选择适当的样品缓冲液,加适量样品促溶剂, 电泳缓冲液时间过长,重新配制,降低凝胶浓度。